[헬스코리아뉴스 / 이시우] 블록버스터 바이오의약품의 특허 만료가 임박하면서, 기존의 바이오의약품과 유사한 바이오시밀러(Biosimilar) 개발 경쟁이 고조되고 있다. 바이오시밀러는 오리지널에 대한 특허 만료 후에야 개발 및 출시가 가능하다는 점 때문에 제품 자체보다 가격 경쟁에 초점을 맞추고 있다. 바이오시밀러는 일단 개발이 완료되면 시장 진출시 제품수명 주기(Product Life Cycle, PLC)가 길어 비교적 안정적인 수익 확보가 가능한 것이 장점이다.
그러나 이보다 더 주목받는 것은 기존 신약의 약효나 복용법 등을 개선한 ‘바이오베터(Biobetter)’ 이다. 바이오베터는 오리지널 약물보다 효능, 안전성, 편의성 등 기능성을 개선한 일종의 개량신약이다. 오리지널 보다 약물의 선택성(Selectivity), 안정성(Stability), 면역원성(Immunogenicity), 반감기(Half-life) 등을 개선해 기존 신약과 다른 새로운 신약으로 탄생한 것이다.
이 때문에 독자적 특허로 보호받을 수 있고 ‘특허 절벽(Patent Cliff)’에서도 자유롭다. 무엇보다 효능(Efficacy)과 안전성(Safety) 측면에서 기존 신약보다 더 뛰어난 우월성을 입증해야 하기 때문에 개발에 성공하면 오리지널 보다도 2~3배 비싼 가격으로 판매할 수 있다.
세계 제약바이오 기업들이 바이오베터 개발에 앞다퉈 나서는 이유다. 한국바이오협회가 최근 발간한 ‘바이오베터 기술 개발 동향’과 관련 업계 정보를 바탕으로 왜 바이오베터를 개발해야하는지 그 이유를 3회에 걸쳐 알아보았다. [편집자 글]
③ 제품 개발 및 임상 현황

신약, 바이오시밀러, 바이오베터의 규제 승인(Regulatory approval)
바이오시밀러의 경우, 품질, 안전성 및 효능 측면을 강조하는 반면, 바이오베터는 법적 또는 규제적 제약이 없다. 바이오베터는 바이오시밀러와 같이 특허 만료를 기다릴 필요는 없지만, 신약과 동일한 규제의 지침을 따르기 때문에, 임상개발 비용이 높을 수밖에 없다. 바이오시밀 러와 바이오베터는 개발 기간 및 단계별 제품의 성공 확률이 다르다. [아래 도표 참조]
![바이오 신약, 바이오 시밀러, 바이오베터의 임상단계에서의 성공확률의 비교 [출처: Drug Discovery Today]](/news/photo/202208/328265_202975_957.png)
바이오시밀러는 전임상 단계에서 성공률(95%)이 가장 높은 반면, 바이오베터는 전임상 단계에서의 성공률(85%)이 바이오 신약과 유사한 수준이다. 그러나, 바이오베터는 신약보다 임상 1상에서의 성공 가능성이 높고, 작용기전으로서의 약물이 이미 임상적으로 검증이 되었기 때문에 임상 3상에서의 성공률이 월등히 높은 편이다.
일반적으로 신약이 개발되기 까지는 약 15년~20년이라는 기간이 소요되며 12억 달러의 투자액으로 시장 진입이 가능하다. 바이오시밀러는 일반적으로 개발을 완료하는데 약 5~8년이 소요되고, 약 1~2억 달러의 투자가 필요한 반면, 바이오베터는 약 10년이 소요되며 5억 달러의 투자액이 필요하다.
국외 바이오베터 개발 현황
#Amgen
미국 암젠은 적혈구(RBC) 수혈의 필요성을 줄이기 위한 목적으로 투석 환자의 만성신장질환(CKD)으로 인한 빈혈 치료제로서 먼저 EPOGEN(epoetin alfa)을 출시했다. 이후, 반감기가 더 긴 형태인 Aranesp(darbepoetin alfa)의 개발에 성공하며, 2001년 FDA 와 EMA의 승인을 받았다.
Aranesp는 이전 골수를 자극하여 적혈구를 만드는 약물인 ESAs(erythropoiesis-stimulating agents) 대비 복용 주기가 길기 때문에 환자의 미충족 욕구에 대한 해결이 가능하다. 즉, 환자는 주사 투여를 덜 받으면서도 동일한 안전성 및 효능을 유지할 수 있다. 이 제품은 당사슬공학(Glycoengineering) 기술을 적용하여, 재조합 단백질 의약품의 성능 향상을 보여주는 대표적인 예라고 할 수 있다.
#Roche
로슈는 자사의 블록버스터 MabThera의 판매가 종료되면서, 후속으로 Gazyva(유럽 제품명: Gazyvaro)를 내놓았다. 이전에 치료받은 적이 없는 만성 림프구성 백혈병 환자를 위한 치료제로, 각각 2021년 말과 2022년 초에 FDA와 이후 EMA의 승인을 받았다. Gazyva(Gazyvaro)는 특정 B세포에서 발현되지만 줄기세포나 형질세포에서는 발현되지 않는 단백질인 CD20에 부착하도록 설계된 조작된 형태의 단일클론항체(mAb)이다. 직접적으로 신체의 면역 체계와 함께 표적 B세포를 공격하고 파괴하도록 설계되었다. 현재 EU와 스위스에서 Gazyvaro로 판매되고 있다.
로슈는 일반적으로 약 3~4시간이 소요되는 약물의 주입시간을 기존 MabThera 제품과 동일하게 90분으로 단축하여, 환자로부터 치료에 대한 부담감을 덜어주었다.
#Biogen
바이오젠은 전세계적으로 약 14만 2000명의 사람들이 겪고 있는 가장 흔한 형태의 A형 혈우병 치료제인 Eloctate를 개발하였고, 2019년 FDA 승인을 받았다. Eloctate는 체내 순환이 장기간 지속되는 형태의 최초의 A형 혈우병 치료제로, Fc-engineering(Fc 융합 단백질) 기술을 활용한 제품이다. 이 제품은 혈우병 및 혈전증 환자의 치료시 발생할 수 있는 출혈 발생, 제어, 예방, 수술 전후의 외과 관리에서의 어려움을 해소시켜 줄 수 있다. Fc 융합 기술은 15년 이상 연구개발에 사용되어 왔지만, 혈우병 치료에 적용한 회사는 바이오젠이 유일하다.
#Merck
머크의 Elonva는 여성의 난소에서 한번에 한 개 이상의 성숙한 난자의 발달을 자극하기 위해 난임 치료를 받는 여성에게 사용되는 호르몬 치료제로, 2010년 EMA의 허가를 받았다.
Elonva는 뇌하수체 전엽에서 분비되는 생식샘 자극 호르몬인 GnRH의 길항제와 함께 사용되어지며, 활성 물질인 Corionic gonadotropin-alpha의 펩타이드가 난포 자극 호르몬인 FSH에 부착되어 체내의 활성을 연장시키는 재조합 단백질 기술을 활용한다.
#Genetech
제넨텍의 Kadcyla는 HER2 양성 초기 유방암 환자가 Herceptin 등 수술 전 보조 치료를 받았음에도 불구하고, 제거된 조직에 암이 남아있는 경우 수술 후 치료제로 사용되는 처방 의약품으로 2013년 FDA의 허가를 받았다. 당시 승인은 Kadcyla가 침습성 유방암 재발 또는 다른 원인으로 사망할 수 있는 위험을 50%(HF=0.50, 95% CI 0.39-0.64, p 〈 0.0001) 줄였다.
![국내·외 바이오베터 허가 현황 [출처: Drug Discovery Today]](/news/photo/202208/328265_202976_136.png)
국내 바이오베터 개발 현황
#한미약품
한미약품의 지속형 바이오신약 개발 기반 기술인 랩스커버리(Lapscovery) TM(Long Acting Protein/ Peptide Discovery)은 단백질 의약품의 반감기를 늘려주는 혁신적인 플랫폼 기술로 평가받는다. 인체 투여 횟수를 줄여 환자의 삶의 질을 높여주며, 투여량을 감소시킴으로써 부작용은 줄이고 효능은 개선하는 기반 기술이라고 할 수 있다.
Lapscovery기술은 기존 PEGylation 기술의 단점을 보완하고자, 항체의 특정 부분(Fc 절편)을 별도로 만들어 화학적 방법으로 연결시키는 원리를 사용, 자유도가 높은 링커(Linker)를 활용하여 타깃과의 반응률을 높이고 약물의 수명을 더 길어지도록 했다. 2022년 5월 분기보고서 기준, 한미약품에서 연구개발중인 LapscoveryTM 파이프 라인은 아래와 같다.
![한미약품 LapscoveryTM 연구개발 현황 [출처: Drug Discovery Today]](/news/photo/202208/328265_202978_1724.png)
#알테오젠
알테오젠은 단백질 캐리어(Carrier)인 NexPTM과 1세대 단백질 치료제를 융합한 융합(Fusion) 기술을 활용하여 체내 지속성이 증가하고 투여 편의성 및 치료 효과가 향상된 차세대 단백질 치료제를 개발하는 원천 기술을 보유하고 있다. NexPTM는 인체에 풍부한 단백질인 Alpha-1 Antitrypsin(A1AT) 내 일부 아미노산을 치환하여 체내 지속성을 늘리고 AIAT 고유의 기능을 없앤 단백질 캐리어다.
이 캐리어는 단백질 의약품에 NexPTM를 융합하여 단백질의약품의 체내 지속성을 증가 시켰다. 또한, 이 기술은 기존의 지속형 바이오베터 기술과는 달리, 거의 모든 단백질이나 펩타이드 치료제에 대해 적용 가능한 범용 기술로 융합 후에도 단백질의약품 자체의 생물학적 활성 저하가 없으며, 제조 효율이 높아 경제성 면에서도 우월하다는 평가를 받는다.
알테오젠은 NexPTM 융합기술을 적용하여, 지속형 인성장 호르몬(Long-Acting Human Growth Hormone, hGH-NexPTM) 제품을 개발 중에 있다. 현재 국내 임상 1b2a상, 인도 1b상을 완료하였으며, 소아 임상 2상을 준비 중에 있다. 이 제품은 전 세계적으로 연간 200만 명으로 추정되는 성장호르몬 수요 환자에 있어서, 반복적으로 성장호르몬을 투여해야 하는 불편함 등의 문제에 있어서 소아 및 성인에게 편의성을 제공함으로써 성장호르몬 시장을 확대시킬 수 있을 것으로 전망된다.

#제넥신
제넥신은 지속형 항체융합단백질을 제조할 수 있는 고유의 항체 융합기술인 hybrid Fc 기술을 보유하고, 이를 이용하여 진보된 바이오베터 제품 및 차세대 바이오신약을 개발하고 있 다. 제넥신의 원천 기술인 hyFc를 인터루킨-7에 융합시킨 형태의 바이오신약 면역항암제 GX-I7파이프라인이 대표적이다. 이 기술은 항암면역치료에 가장 중요한 T 세포 증식 기전을 가지고 있어 면역을 이용한 항암치료에 중요한 핵심 기술로서 활용된다.
제넥신은 GX-H9과 같이 성장호르몬에 hyFc를 융합시킨 희귀질환치료제를 개발중에 있으며, 이 밖에도 지속형 빈혈치료제 GX-E4와 PEGylation 기술 대비 긴 반감기와 안전성을 가지는 GX-G3 (호중구 감소증 치료 제)등의 파이프라인이 있다. 아래는 GX-I7 파이프라인을 중심으로 정리한 것이다.
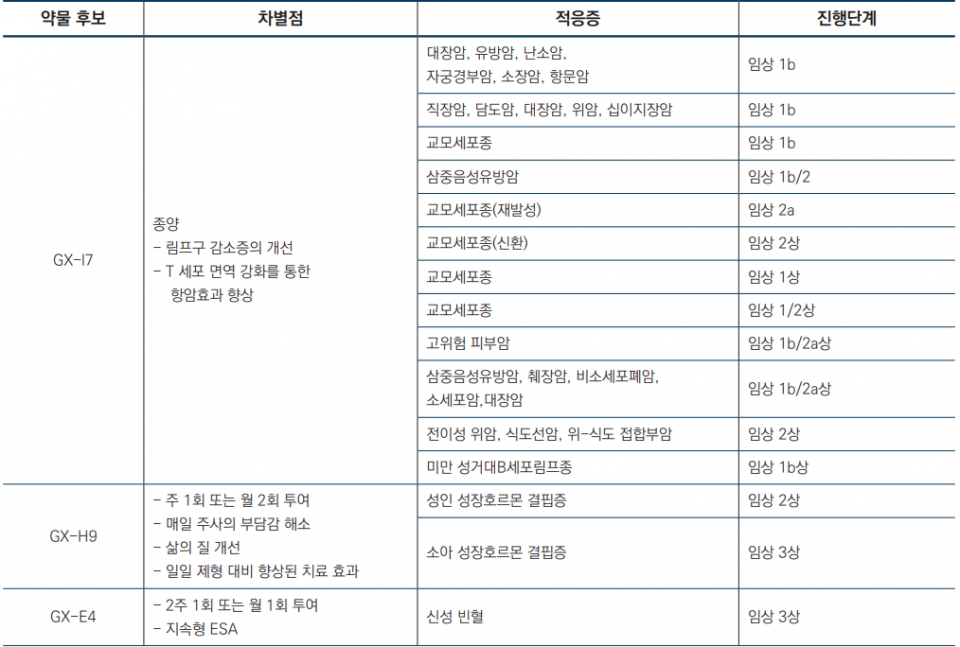
#GC녹십자
GC 녹십자의 헌터증후군 치료제인 헌터라제(Hunterase)는 보행거리 증가와 요중 GAG 배설 감소에 있어서 오리지널 의약품인 Elaprase 대비 유효성이 개선된 바이오베터이다. 헌터 라제는 2021년 1월 일본에서 점액다당류증 II 형(헌터 증후군) 치료제로 Hunterase ICV 주사제 15mg 용량으로 제조 및 판매 승인을 받았다. 현재, 환자의 약 70%가 앓고 있는 중추 신경계 증상을 표적으로 하는 치료제가 없는 상황에서, 새로 승인된 형태의 Hunterase ICV Injection 15mg는 뇌와 중추신경계 세포에 도달하여 뇌실(Cerebral ventricles)에 직접 전달되기 때문에 정신 운동 발달 지연과 같은 질병을 완화할 수 있을 것으로 기대된다.
대부분의 바이오의약품 기업들은 바이오시밀러를 안정적인 캐시카우(Cashcow) 전략으로 활용하면서 한편으로는 바이오베터를 신성장 동력으로 두고 있다. 바이오베터는 바이오신약과 달리 기존 바이 오의약품의 낮은 반감기와 선택성, 유효성을 개선하고 부작용이 있는 경우 안전성을 보완할 수 있고, 임상 시험에서 신약만큼 성공확률에 대한 불확실성이 크지 않다. 무엇보다 바이오와 관련된 유전자재조합, 단백질 공학 기술의 진입장벽이 높고 고비용이 요구되어 케미칼의약품 대비 경쟁사의 사업화가 어려운 장점이 있다.
바이오경제연구센터 김지운 선임연구원은 “바이오베터의 임상 성공 가능성은 신약보다 상대적으로 높고 동시에 허가에 대한 허들은 신약보다 낮기 때문에, 기업의 독자적인 기술 플랫폼을 갖추는 것이 무엇보다 중요하다”며 “한미약품, 알테오젠, 제넥신의 경우 약물의 반감기를 증가시켜 투여횟수를 줄이고 부작용을 감소시키는 지속형 바이오베터 기술을 사용하거나 제형을 변경하는 독자적인 기술 플랫폼을 갖추고 있는 대표적인 사례가 될 수 있다”고 말했다.






