
[ソウル/ヘルスコリアニュース]食品医薬品安全処が29日、(株)セルトリオンで開発したコロナ19治療剤「レキローナージュ960mg」(レグダンビーマップ)(コード名:CT-P59)に対して直ちに許可審査に着手した。 セルトリオンは同日、食薬処に品目許可を申請した。
今回許可を申請した「レキローナージュ」は(株)セルトリオンで新薬として開発中の遺伝子組み換え中和抗体治療剤だ。
「レキローナージュ」の主成分はレグダンビマブ(Regdanvimab)という国際一般名を与えられたコロナ19中和抗体で、コロナ19完治者の血液に存在する中和抗体遺伝子を選別·採取した遺伝子を大量生産が可能な宿主細胞に挿入(組み換え)し、細胞培養過程を通じて大量に生産することになる。
[用語説明]
# 国際一般名(INN, International Non-proprietary Name) : WHO(世界保健機関)が決定する医薬品の原料名(一般名)をいう。 欧米などほとんどの国が処方時にINN を使用するため、医薬品開発の中で極めて重要な段階である。
#コロナ19 中和抗体:コロナ19 ウイルスを中和(無力化)できる抗体をいう。
したがって「レキロナージュ」はコロナ19完治者の血液から抗体を持続的に採取する必要がなく、遺伝子が組み替えられた細胞を利用して中和抗体を大量生産できるのが長所だ。
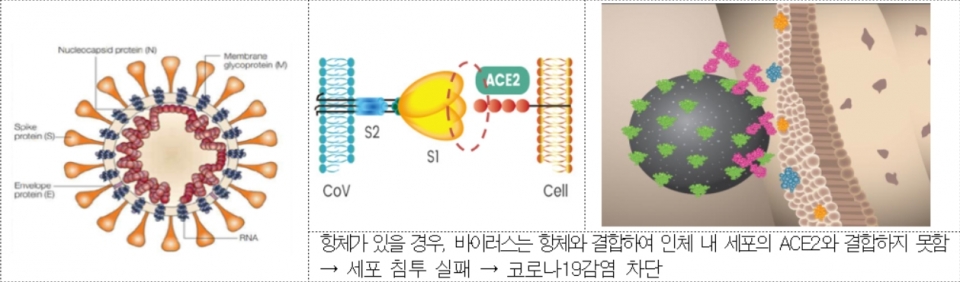
従来、治療剤として許可された「ベクルリジュ」(レグダンビィル)は、細胞内の感染したコロナ19 ウイルスの複製を抑制するのに対し、「レグダンビィマップ」は、コロナ19 ウイルスの表面にある人体細胞結合部位(Receptor Binding Domain)に抗体治療剤が代わりに結合することで、ウイルスが細胞内に浸透するのを防ぐ役割を果たす。
「レキローナージュ」の予想対象患者は軽症から中等症までのコロナ19患者で,予想用法と剤形は90分間静脈投与する注射剤である 予想される効能·効果は軽症·中等症コロナ19患者の治療である。
食薬処は今年2月、同製品の開発初期から許可申請まで、製造会社と密接な相談を行い、臨床2相期間を10ヵ月へと大幅に短縮し、完了した。
セルトリオンは食薬処から2賞と3賞を同時に承認された多国家臨床試験のうち、2賞を完了して許可を申請するもので、3賞は今回の許可申請とは関係なく計画通り進める予定だ。
食薬処は申請製品に対する許可審査及び専門家諮問の結果、安全性·効果性が十分確認された場合、現在進行中の3相臨床試験の結果を許可後に提出することを条件に許可する計画だ。
食薬処は今回の許可申請製品をはじめ、コロナ19ワクチン·治療剤の迅速な許可·審査のため、従来の処理期間(180日以上)を短縮し、40日以内に処理することを目標としている。 したがって早ければ来年2月初め、国産コロナ19治療剤が正式許可を受け、商用化されるものと期待される。
ヘルスコリアニュース(http://www.hkn24.com)






